El angioma se define médicamente como una proliferación benigna de estructuras vasculares que puede manifestarse en los tejidos orales y periorales, caracterizada por un crecimiento anormal de vasos sanguíneos o linfáticos que forman una masa tumoral de naturaleza no neoplásica. Esta lesión vascular representa una de las alteraciones más frecuentes del sistema circulatorio en la cavidad oral, clasificándose dentro de las malformaciones vasculares según la taxonomía internacional de la Organización Mundial de la Salud.
Etimológicamente, el término proviene del griego «angeion» (vaso) y el sufijo «-oma» (tumor o masa), literalmente significando «tumor de vasos». Los sinónimos más utilizados incluyen hemangioma en español, angioma en inglés, hémangiome en francés, y Angiom en alemán. Según la clasificación internacional CIE-10, los angiomas orales se codifican bajo D18.0 (hemangioma de cualquier sitio) y K13.4 (granuloma y lesiones reactivas de la mucosa oral).
El concepto fue descrito inicialmente por Rudolf Virchow en 1863, quien estableció las bases histopatológicas de estas lesiones vasculares. La evolución del concepto ha progresado significativamente con los avances en microscopía electrónica y técnicas de inmunohistoquímica, permitiendo una comprensión más precisa de su naturaleza.
Los estudios epidemiológicos más recientes indican una prevalencia del 0.5-1.2% en la población general, con una predilección por el sexo femenino en una proporción de 3:1. La incidencia es mayor durante la segunda y tercera décadas de la vida, aunque puede presentarse a cualquier edad. En el ámbito odontológico, los angiomas representan aproximadamente el 16% de todas las lesiones benignas de los tejidos blandos orales.
La relevancia clínica actual en odontología moderna se centra en el diagnóstico diferencial precoz, especialmente por su capacidad de sangrado profuso durante procedimientos quirúrgicos menores, lo que puede complicar significativamente el manejo clínico. Su importancia radica también en la necesidad de diferenciarlo de lesiones malignas vasculares como el angiosarcoma y el sarcoma de Kaposi.
Los mecanismos moleculares subyacentes en la formación de angiomas involucran una desregulación en los procesos de angiogénesis y vasculogénesis. A nivel celular, se produce una proliferación anormal de células endoteliales mediada por factores de crecimiento específicos, principalmente el factor de crecimiento endotelial vascular (VEGF), el factor de crecimiento derivado de plaquetas (PDGF) y la angiopoyetina-1.
Los procesos bioquímicos involucran la activación de cascadas de señalización intracelular, particularmente las vías PI3K/Akt y MAPK/ERK, que regulan la proliferación y diferenciación de las células endoteliales. La metaloproteínasa de matriz MMP-2 y MMP-9 desempeñan un papel crucial en la degradación de la matriz extracelular, facilitando la migración celular y la formación de nuevos vasos.
A nivel tisular, se observa una alteración en el equilibrio entre factores proangiogénicos y antiangiogénicos. La hipoxia local actúa como desencadenante inicial, activando el factor inducible por hipoxia (HIF-1α), que a su vez estimula la transcripción de genes relacionados con la angiogénesis.
Los factores genéticos incluyen mutaciones en genes reguladores de la angiogénesis como TIE2, GLUT1 y VEGFR2. Estudios recientes han identificado alteraciones epigenéticas en la metilación del ADN que afectan la expresión de genes supresores de la angiogénesis.
Desde el punto de vista biomecánico, la presión intravascular elevada (12-15 mmHg) dentro de los espacios vasculares dilatados genera tensiones sobre los tejidos circundantes, explicando la tendencia al crecimiento progresivo y la fragilidad vascular característica. La distribución de cargas se ve alterada por la menor resistencia del tejido angiomatoso comparado con el tejido normal circundante.
Las teorías fisiopatológicas actuales sugieren un origen multifactorial que combina predisposición genética, factores hormonales y traumatismo local, contrastando con teorías históricas que consideraban estos angiomas como malformaciones congénitas puras.
Macroscópicamente, los angiomas orales se presentan como lesiones de coloración característica que varía desde el rojo intenso hasta el púrpura oscuro, dependiendo del tipo y profundidad de los vasos involucrados. La superficie puede ser lisa, lobulada o verrugosa, con un diámetro que oscila entre 2-30 milímetros, aunque excepcionalmente pueden alcanzar tamaños superiores a 5 centímetros.
La textura es típicamente blanda y compresible, presentando el signo de la vitropresión positiva (palidecimiento bajo presión del portaobjetos). La forma puede ser sésil o pedunculada, con tendencia al sangrado espontáneo o ante traumatismos mínimos.
Microscópicamente, se observa una proliferación de capilares y vénulas con endotelio normal, organizados en lobulillos separados por septos fibrosos. Los espacios vasculares están dilatados y contienen eritrocitos, con paredes vasculares de grosor variable. La tinción inmunohistoquímica es positiva para CD31, CD34 y Factor VIII.
La distribución anatómica muestra predilección por los labios (45% de los casos), seguido por la lengua (25%), mucosa yugal (15%) y encías (10%). En el labio, la localización más frecuente es el bermellón del labio inferior. En la lengua, predomina en los dos tercios anteriores, especialmente en los bordes laterales.
Las variaciones según edad muestran que en pacientes jóvenes prevalecen los tipos capilares con crecimiento rápido, mientras que en adultos mayores son más frecuentes los tipos cavernosos con evolución lenta. No se observan diferencias significativas según sexo o raza, aunque algunas series reportan mayor frecuencia en pacientes de origen mediterráneo.
Los patrones de presentación incluyen formas unilaterales (85% de los casos) y bilaterales (15%), siendo estas últimas más frecuentes en angiomas congénitos. La presentación puede ser localizada (lesión única) o multifocal (múltiples lesiones en diferentes sitios).
La progresión temporal típica incluye una fase de crecimiento rápido durante los primeros 6-12 meses, seguida de una fase de estabilización. El signo patognomónico más característico es la compresibilidad con restauración inmediata de la forma original al cesar la presión.
Las causas primarias incluyen alteraciones en el desarrollo embriológico de los vasos sanguíneos durante la sexta y décima semana de gestación, cuando se establece la red vascular primitiva. Mutaciones en genes reguladores como VEGFR2, TIE2 y PDGFR constituyen factores determinantes en el 15-20% de los casos.
Las causas secundarias abarcan traumatismos mecánicos repetitivos, especialmente en zonas de fricción como bordes dentales irregulares, prótesis mal ajustadas y hábitos parafuncionales. La irritación crónica actúa como desencadenante de la proliferación vascular a través de la liberación de mediadores inflamatorios.
Los factores predisponentes genéticos incluyen antecedentes familiares de malformaciones vasculares (riesgo relativo: 3.2), síndrome de Maffucci, síndrome de Kasabach-Merritt y esclerosis tuberosa. Los factores ambientales comprenden exposición solar prolongada, especialmente para angiomas labiales, y deficiencias nutricionales de vitamina C y bioflavonoides.
Los factores hormonales desempeñan un papel crucial, evidenciado por el crecimiento acelerado durante el embarazo (incremento del 65% en el tamaño), la pubertad y el uso de anticonceptivos orales. Los estrógenos estimulan la expresión de VEGF y la proliferación endotelial.
Entre los cofactores se incluyen la hipertensión arterial (odds ratio: 2.1), diabetes mellitus tipo 2 (OR: 1.8) y el tabaquismo (OR: 1.5). Los factores protectores identificados son el consumo regular de antioxidantes, ejercicio físico moderado y control estricto de la presión arterial.
Las interacciones medicamentosas relevantes incluyen el uso prolongado de corticosteroides tópicos que pueden enmascarar la lesión, y anticoagulantes que incrementan el riesgo de sangrado espontáneo. Las condiciones sistémicas asociadas comprenden cirrosis hepática, insuficiencia cardíaca congestiva y coagulopatías.
Los hábitos y estilos de vida influyentes incluyen el bruxismo nocturno, mordedura crónica de labios y mejillas, y el uso de piercings orales. Los factores socioeconómicos muestran mayor incidencia en poblaciones con acceso limitado a atención odontológica preventiva.
El diagnóstico diferencial debe incluir prioritariamente el granuloma piógeno, que presenta características clínicas similares pero con mayor tendencia al sangrado y crecimiento más rápido. El granuloma piógeno muestra positividad para Ki-67 en la inmunohistoquímica, mientras que el angioma es típicamente negativo.
La fibroma periférica se diferencia por su coloración rosada, consistencia firme y ausencia de compresibilidad. Histológicamente presenta predominio de tejido fibroso maduro sin componente vascular significativo. La hiperplasia fibromatosa muestra similar consistencia pero mayor tamaño y forma irregular.
El carcinoma de células escamosas en estadios iniciales puede simular un angioma, especialmente en pacientes mayores de 50 años. La biopsia es mandatoria para la diferenciación, mostrando el carcinoma atipia celular, mitosis atípicas y invasión tisular.
El sarcoma de Kaposi representa el diagnóstico diferencial más crítico, caracterizado por lesiones múltiples, evolución rápida y positividad para HHV-8. La inmunohistoquímica muestra positividad para CD34 y Factor VIII, pero con patrón de crecimiento infiltrativo.
El linfangioma se diferencia por su coloración amarillenta translúcida, contenido líquido claro y negatividad para Factor VIII. El neurofibroma presenta consistencia elástica pero sin compresibilidad vascular.
Los métodos diagnósticos específicos incluyen dermatoscopía para evaluación de patrones vasculares, ecografía Doppler para determinación del flujo sanguíneo, y resonancia magnética en lesiones profundas para evaluación de extensión.
La biopsia incisional está indicada en lesiones mayores de 1 centímetro o con características atípicas. La sensibilidad de la evaluación clínica es del 78%, mientras que la especificidad de la confirmación histopatológica alcanza el 95%.
Los algoritmos diagnósticos recomiendan iniciar con evaluación clínica, seguida de dermatoscopía si está disponible, y biopsia en casos dudosos o lesiones de gran tamaño. Las limitaciones diagnósticas incluyen la similitud clínica con otras lesiones vasculares y la variabilidad en la presentación según la localización.
El algoritmo terapéutico se basa en la clasificación por severidad: lesiones pequeñas asintomáticas (<5mm) pueden manejarse con observación clínica y controles periódicos cada 6 meses. Las lesiones sintomáticas o de crecimiento progresivo requieren intervención activa.
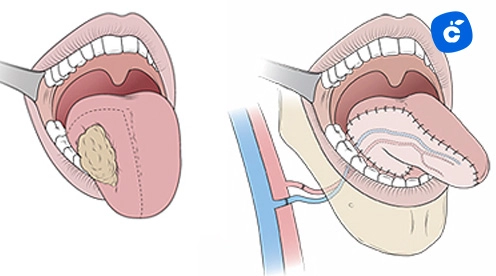
El tratamiento de primera línea para angiomas menores de 10mm es la escisión quirúrgica simple con márgenes de seguridad de 2mm. La técnica incluye hemostasia previa con epinefrina 1:100,000, incisión elíptica, disección cuidadosa y sutura con nylon 5-0 o 6-0. La tasa de éxito es del 95% con recurrencia menor al 2%.
Para lesiones de 10-20mm, se recomienda electrocirugía con asa diatérmica, utilizando corriente de corte pura a 30-40 watts. El láser de CO2 representa una alternativa efectiva con longitud de onda de 10.6 micrones, potencia de 8-12 watts en modo continuo, ofreciendo mejor hemostasia y menor edema postoperatorio.
El tratamiento de segunda línea incluye criocirugía con nitrógeno líquido (-196°C) aplicado durante 20-30 segundos en 2-3 ciclos, efectiva para lesiones superficiales menores de 8mm. La escleroterapia con oleato de etanolamina al 5% inyectado intralesionalmente cada 2-3 semanas muestra eficacia del 78% en angiomas cavernosos.
Las técnicas quirúrgicas avanzadas para lesiones extensas incluyen resección en bloque con reconstrucción mediante colgajos locales. En angiomas labiales extensos, puede requerirse vermillectomía parcial con reconstrucción del bermellón.
Los materiales específicos incluyen suturas reabsorbibles (Vicryl 4-0) para planos profundos y suturas no reabsorbibles (Prolene 5-0) para piel. El control hemostático puede requerir celulosa oxidada (Surgicel) o esponja de gelatina (Gelfoam).
El protocolo de seguimiento incluye control a las 48 horas, 7 días, 1 mes y 3 meses postoperatorios. Las complicaciones más frecuentes son sangrado postoperatorio (8% de los casos), infección secundaria (3%) y cicatrización hipertrófica (5%).
Las contraindicaciones absolutas incluyen trastornos de coagulación no controlados, INR >2.5, y angiomas con sospecha de malignidad. Las contraindicaciones relativas comprenden embarazo, diabetes descompensada y uso de anticoagulantes.
En poblaciones especiales, los niños menores de 12 años requieren sedación consciente o anestesia general. En embarazadas se prefiere tratamiento conservador hasta el posparto. En ancianos, la evaluación cardiovascular previa es mandatoria.
La evolución natural sin tratamiento muestra estabilización espontánea en el 60% de los casos después de 2-3 años, con crecimiento progresivo lento en el 30% y regresión parcial en el 10% restante. Los angiomas menores de 5mm tienen mayor tendencia a la estabilización comparados con lesiones de mayor tamaño.
El pronóstico con tratamiento temprano es excelente, con tasas de curación del 95-98% y mínimo riesgo de recurrencia (1-3%). El tratamiento tardío, después de 5 años de evolución, reduce la tasa de éxito al 85% debido a la mayor vascularización y fibrosis asociada.
Los factores pronósticos favorables incluyen edad joven (<30 años), tamaño menor a 10mm, localización labial, tipo capilar histológico y ausencia de traumatismo repetitivo. Los factores desfavorables comprenden edad avanzada, localización lingual profunda, tipo cavernoso y antecedentes de recurrencia.
Las tasas de éxito específicas por modalidad terapéutica son: escisión quirúrgica 95%, láser CO2 92%, electrocirugía 88%, criocirugía 82% y escleroterapia 78%. La recurrencia global es menor al 5% a 5 años de seguimiento.
Las complicaciones tardías incluyen cicatrización hipertrófica (7% de los casos), alteraciones de la sensibilidad (2%) y recurrencia local (3%). La calidad de vida postratamiento es excelente en el 94% de los pacientes.
El seguimiento a largo plazo debe mantenerse durante 2 años mínimo, con controles cada 6 meses el primer año y anuales posteriormente. La vigilancia de por vida está indicada en pacientes con angiomatosis múltiple o síndromes asociados.
La prevención primaria se centra en la eliminación de factores traumáticos como bordes dentales filosos, restauraciones defectuosas y prótesis mal ajustadas. El control de hábitos parafuncionales mediante guardas oclusales y terapia conductual reduce significativamente el riesgo de desarrollo.
La prevención secundaria incluye exámenes odontológicos periódicos cada 6 meses para detección temprana de lesiones incipientes. El entrenamiento del paciente en autoexamen oral permite identificación precoz de cambios en tejidos blandos.
Las medidas individuales comprenden higiene oral óptima, uso de dentífricos con flúor, enjuagues antisépticos y protección labial con filtros solares FPS >30 en actividades al aire libre. La dieta rica en antioxidantes (vitamina C, E, bioflavonoides) puede tener efecto protector.
Los programas de screening recomendados incluyen fotografía clínica digital en pacientes de alto riesgo para seguimiento objetivo de lesiones sospechosas. La educación del paciente debe enfatizar la consulta inmediata ante aparición de lesiones de crecimiento rápido o sangrado espontáneo.
Las modificaciones del estilo de vida incluyen cesación del tabaquismo, control del estrés, ejercicio regular moderado y control de peso. Las intervenciones profesionales preventivas comprenden aplicación de fluoruros, sellado de fisuras y eliminación de placa bacteriana.
Las líneas de investigación actuales se enfocan en la terapia génica antiangiogénica utilizando vectores virales para entregar genes codificantes de endostatina y angiostatina. Los estudios preclínicos muestran resultados prometedores en modelos animales.
Los tratamientos en desarrollo incluyen inhibidores específicos de VEGF como bevacizumab tópico, inhibidores de mTOR como rapamicina y moduladores de la vía Notch. La nanotecnología ofrece sistemas de liberación controlada de fármacos antiangiogénicos.
Las tecnologías emergentes comprenden microscopía confocal in vivo para diagnóstico no invasivo, tomografía de coherencia óptica para evaluación de profundidad y espectroscopía de fluorescencia para caracterización tisular.
Los avances en diagnóstico incluyen biomarcadores séricos como VEGF, angiopoyetina-2 y PDGF para monitoreo no invasivo. La inteligencia artificial aplicada a dermatoscopía digital mejora la precisión diagnóstica.
Las terapias regenerativas investigan el uso de células madre mesenquimales y factores de crecimiento para regeneración tisular postquirúrgica. Los estudios clínicos en curso evalúan la eficacia de inmunoinmunomoduladores tópicos.
La medicina personalizada busca identificar perfiles genéticos que predigan respuesta terapéutica y riesgo de recurrencia. Las controversias actuales incluyen el papel de la terapia hormonal en angiomas relacionados con embarazo.
Las interacciones con otras especialidades requieren coordinación con dermatología para angiomas cutáneos asociados, oftalmología en casos de angiomatosis facial con compromiso ocular, y otorrinolaringología para lesiones con extensión a vías aéreas superiores.
La derivación a hematología está indicada cuando se sospecha síndrome de Kasabach-Merritt o coagulopatías asociadas. El manejo multidisciplinario con cirugía plástica es necesario en angiomas extensos que requieren reconstrucción compleja.
Las implicaciones sistémicas incluyen la evaluación de angiomatosis múltiple que puede asociarse con malformaciones viscerales. Los aspectos psicológicos comprenden el impacto estético especialmente en adolescentes, requiriendo apoyo psicológico en casos seleccionados.
Las consideraciones éticas incluyen el consentimiento informado detallado sobre riesgos quirúrgicos y posibles complicaciones estéticas. En menores de edad, se requiere evaluación del beneficio-riesgo y participación familiar en la toma de decisiones.
¿Son los angiomas orales lesiones cancerosas? Los angiomas son lesiones benignas compuestas por vasos sanguíneos proliferados que no tienen potencial maligno. Sin embargo, requieren evaluación profesional para confirmar el diagnóstico y descartar otras lesiones vasculares que pueden tener comportamiento diferente.
¿Por qué sangran tanto los angiomas durante los procedimientos dentales? Los angiomas están formados por múltiples vasos sanguíneos dilatados con paredes delgadas, lo que los hace extremadamente vulnerables al trauma. Su rica vascularización y la baja resistencia vascular explican el sangrado profuso que puede complicar procedimientos menores.
¿Pueden los angiomas desaparecer por sí solos? Aproximadamente el 10% de los angiomas pequeños pueden experimentar regresión espontánea, especialmente en pacientes jóvenes. Sin embargo, el 60% se estabilizan y el 30% continúan creciendo, por lo que se recomienda evaluación profesional para determinar el manejo apropiado.
¿Es seguro el tratamiento con láser para angiomas orales? El láser de CO2 es una modalidad terapéutica segura y eficaz para angiomas orales, con tasas de éxito del 92% y excelente control hemostático. Ofrece ventajas como menor edema postoperatorio y cicatrización más estética comparado con técnicas quirúrgicas convencionales.
¿Los angiomas orales están relacionados con problemas cardíacos? No existe relación directa entre angiomas orales aislados y patología cardiovascular. Sin embargo, en casos de angiomatosis múltiple, puede requerirse evaluación sistémica para descartar malformaciones vasculares en otros órganos que podrían tener implicaciones cardiovasculares.

